
|
|
II-RA PROZESSRECHNER SS03 - Vorlesung mit Übung
|
Aufgrund des Ausfalls der zweiten Vorlesung soll hier nochmals an die erste Vorlesung angeknüpft werden. In der ersten Vorlesung wurde darauf hingewiessen, dass der eigentlichen Konstruktion und Programmierung des Prozessrechners die Analyse der Anforderungen sowie die Erstellung eines formalen Modells vorausgehen muss. Dies sei hier nochmals an einem Beispiel erläutert.
STARTIm nachfolgenden Bild wird eine kurze Erläuterung zu den typischen Phasen der Modellierung gegeben:
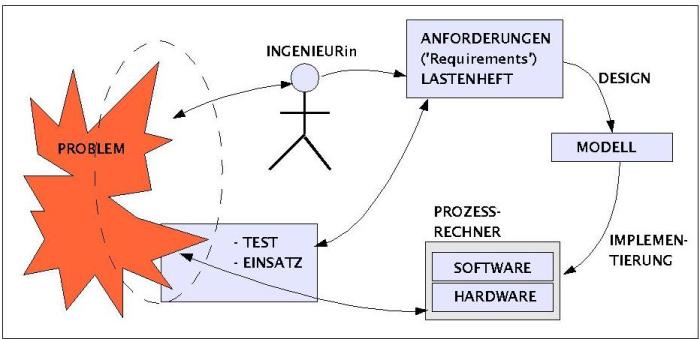
Modellierung
Konfrontiert mit einem zunächst unscharfen Problem obliegt es dem Ingenieur in Zusammenarbeit mit allen vom Problem Betroffenen die entscheidenden Anforderungen des Problems herauszuarbeiten. Sind diese fixiert ('requirements-engineering'), muss er versuchen, ein formales Modell entsprechend den expliziten Anforderungen und den verfügbaren Daten zu erarbeiten. Je nach methodischem Kontext (beispielhaft genannt wurden: Kontrolltheorie, Kybernetik, Systemtheorie, Strukturtheorie, Softwareengineering) kann dies zu unterschiedlichen Anforderungen führen die mit unterschiedlichen Methoden gelöst werden. Liegt ein Modell vor, dann kann man auf dieser Basis einen konkreten Prozessrechner bauen bzw. verfügbare Hardware und Softwaretools benutzen, um sie für die anstehende Aufgabe zu modifizieren. Schliesslich muss der Prozessrechner entsprechend den Anforderungen ausfführlichen Tests unterzogen werden; verlaufen diese alle positiv, dann kann der Prozessrechner zum Einsatz kommen.Zur Auslieferung gehören entsprechende Dokumentation sowohl für den Endbenutzer als auch für die interne Wartung.
Im nächsten Schritt soll nun eine Modellierung konkret durchgeführt werden. Als methodischen Rahmen wählen wir eine Schnittmenge aus Kontrolltheorie/ Systemtheorie und Strukturtheorie. Als konkretes Problem nehmen wir Ergebnisse der modernen Neurobiologie, d.h. wir nehmen uns Teilaspekte eines lebenden Neurons und untersuchen, wieweit wir ein Modell bauen können, das Teile eines realen Neurons so simulieren kann, dass man es eventuell als ein neues Bauteil im Rahmen von technischen Prozessen einsetzen kann. Ein Neuron ist eine sehr vielseitige Struktur. Man kann ein Neuron u.a. auffassen als einen Kontroller, der Prozesse steuert, als komplexes Schaltelement oder auch als eine biologische Version einer Turingmaschine.
STARTAls Anwendungsbeispiel wählen wir die moderne Neurobiologie und die Aufgabe, auf der Basis der neueren neurobiologischen Daten Modelle zu bauen, die zumindest einige der Eigenschaften von realen Neuronen zu simulieren.
Hintergrund ist die Erkenntnis, dass neurologische Stukturen für einen Grossteil der Informationsverarbeitung in einem biologischen Organismus verantwortlich sind, und speziell sogenannte 'höhere Intelligenzleistungen' ausschliesslich durch neuronale Strukturen realisiert werden. Die Steuerleistungen neuronaler Strukturen sind immens und es verwundert von daher nicht, dass auch die Technik immer mehr Anleihen bei neurologischen Informationsverarbeitungsstrukturen macht. Neuronale Netze, neuronale Schaltkreise gehören immer mehr zu einem heute kaum noch wegzudenken Teil diverser Signalverarbeitungs- und Steuerungstechnologien.
Neuronale Strukturen (für das Folgende benutzen wir die beiden Standardlehrbücher [PENZLIN 1996] und [SHEPHERD 1994]) bestehen grob gesagt aus Gehirnzellen (Neuronen), die untereinander Signale austauschen können. Ein schon stark idealisiertes Neuron wird im folgenden Schaubild gezeigt:
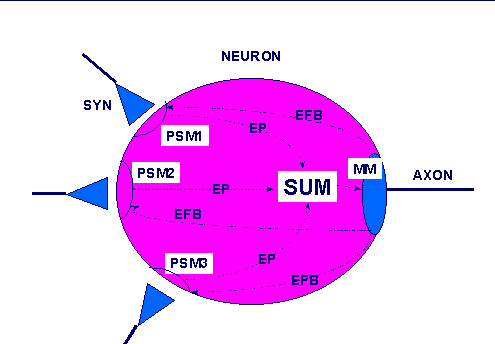
Reales Neuron (idealisiert)
Das Diagramm zeigt ein Neuron, in dem von links kommenden drei Endstücke ('endbulbs') von anderen Axonen enden. Gegenüber einem Endstück (siehe auch nächstes Bild) liegt dann eine sogenannte Membran. Endstück zusammen mit einer Membran bilden eine Synapse. Man spricht daher auch von einer postsynaptischen Membran ('PSM := 'Postsynaptic membrane'). Die postsynaptischen Membranen gehören zum Körper (griechisch 'soma') des Neurons. Auf der Basis bestimmter chemischer Prozesse in den Membranen (siehe unten) können sich an den postsynaptischen Membranen elektrische Ladungen ausbilden, die sich in Form von Spannnungspotentialen durch das Soma fortpflanzen können. Am 'rechten Ende' des Somas befindet sich der sogenannte Hügel (engl. 'hillock'). Hier 'sammeln' sich die verschiedenen Potentiale des Somas und können, falls sie einen bestimmten Schwellwert überschreiten, ebenfalls eine Spannungsspitze generieren. Diese Spannungsspitze pflanzt sich dann über das Axon bis zu den Endstücken fort. Während ein Neuron bis ca. 60.000 Endstücke 'empfangen' kann und auch bis zu ca. 25.000 Endstücke selbst 'verschicken' kann, hat ein Neuron genau ein Soma und nur ein Axon. Die detaillierten chemischen und elektrischen Prozesse in einem Neuron sind sehr komplex und sollen hier vorläufig nicht weiter analysiert werden. Wir konzentrieren uns vorläufig nur auf die postsynaptischen Membranen (siehe unten) und hier auch nur auf erste Grundfunktionen.
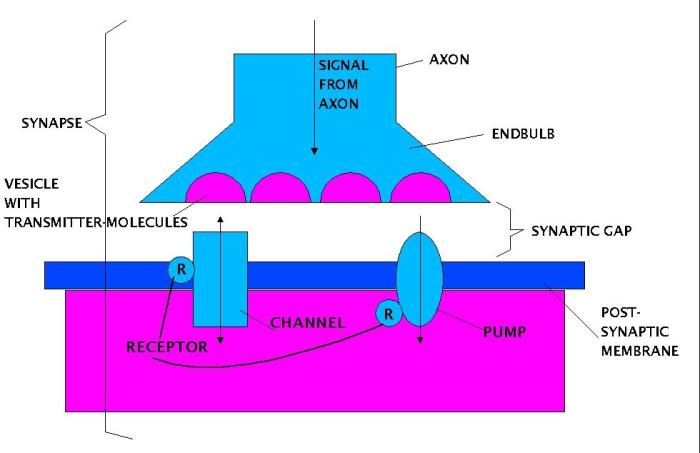
Synapse
Das vereinfachte Grundprinzip kann man so darstellen, dass eine Spannungsspitze, die als Ladung an einem Axon weitergeleitet wird, in den Endstücken bei genügender Stärke und 'entsprechenden Bedingungen' dazu führt, dass die Vesikel in den Endstücken sich öffnen und die darin enthaltenen Transmittermoleküle in den synaptischen Spalt ('synaptic gap') hinein ausgeschüttet werden. Diese Transmittermoleküle diffundieren dann durch diesen synaptischen Spalt und einige gelangen zur Oberfläche der postsynaptischen Membran. Diese Oberfläche enthält u.a. Rezeptormoleküle, Ionenkanäle und Ionenpumpen. Im 'Normalzustand' sind die Ionenkanäle geschlossen und die Ionenpumpen sind nicht aktiv. Falls das Rezeptormolekül eines Ionenkanals 'empfänglich' ist für die Art der Moleküle, die als Transmittermoleküle in den synaptischen Spalt hinein ausgeschüttet werden, dann kann solch ein Transmittermolekül an einem Rezeptormolekül 'andocken', vorausgesetzt, die Andockstelle wird nicht schon von einem anderen Molekül blockiert. Ein Transmittermolekül kann zwei unterschiedliche Wirkungen haben: es kann entweder 'aktivierend' auf den Kanal wirken oder 'blockierend'. Ferner muss man die Zeitdauer berücksichtigen, wie lange ein Transmittermolekül an einem Rezeptormolekül angedockt sein kann. Im Falle eines aktivierenden Transmittermoleküls (z.B. ACh, Glutamat, Glycin, GABA) führt dies dazu, dass sich ein Ionenkanal innerhalb von Milisekunden öffnet. Bei einem geöffneten Ionenkanal besteht die Möglichkeit, dass einzelne Ionen einer bestimmten Art (z.B. Na+, Cl-, K+, Ca2+ usw.) durch solch einen Kanal hindurchdiffundieren können. In welcher Richtung sie diffundieren, hängt von dem aktuellen Konzentrationsgefälle ab: wenn intern in der postsynaptischen Membran zum Zeitpunkt der Öffnung z.B. eine höhere Konzentration von Kalium K+ herrschen würde als extern im synaptischen Spalt, dann würden Kalium-Ionen von innen nach aussen wandern.In der Regel schliesst sich ein Kanal wieder nach wenigen Milisekunden. Andere Formen von Ionenkanälen (spannungsgesteuert, mechanisch gesteuert) sowie andere Formen von Rezeptoren (z.B. Metabotrope) bleiben hier zunächst ausser Betracht.
Neben dem passiven Ionentransport mittels Ionenkanälen gibt es auch noch einen aktiven Transport entgegen einem Konzentrationsgefälle, durch sogenannte Ionenpumpen. Ionenpumpen können diese Aufgabe aber nur leisten, weil sie dafür Energie verbrauchen. Bezogen auf den Energievrbrauch einer Zelle kann kann der Energieverbrauch im Kontext der Ionenumpen zwischen 20 und 75% des gesamten Energieverbrauchs einer Zelle ausmachen! Die Tätigkeit der Ionenpumpen wird selbst wieder von spezifischen Rezeptormolekülen gesteuert. Eine Variante --die im Diagramm angenommen wurde-- besteht darin, dass eine Ionenpumpe in Abhänhihkeit von einem voreingestellten Konzentrations-Sollwert arbeitet. Fällt die Konzentration einer bestimmten ionisierten substanz unter einen Schwellwert, schaltet die Punpte ein, überschreitet sie einen bestimmten Schwellwert, schaltet sie wieder aus.
Aufgrund der Tatsache, dass Ionen wegen ihrer überschüssigen (negativ) oder fehlenden Elektronen (positiv) eine spezifische elektrische Ladung tragen, besteht zwischen den Ionen-Konzentration ausserhalb der Membran und innerhalb der Membran eine Potetialdifferenz, die man als elektrische spannung messen kann. Sei angenommen die Konzentration der Substanz ausserhalb sigma_e und innerhalb sigma_i --beide gemessen in Mili-Mol [mmol]--, dann kann man mit der sogenannten Nernst-Gleichung diese Potentialdifferenz ermitteln (für Details siehe [MORTIMER 1996]).
E = - 2.303 * (R /F) * T/z_sigma * log( sigma_e / sigma_i );
R := Gas Constant 8.3145 [J/mol K]
F := Farady Constant 96 485 [C/mol]
T := Temperature in Kelvin
z_sigma := valence of the ion
sigma_i := internal concentration [mmol]
sigma_e := external concentration [mmol]
Kelvin := Celsius + 273.15
E = - 0.0001985 [V] * T/z_sigma * log( sigma_e / sigma_i )
E = - 0.1985 [mV] * T/z_sigma * log( sigma_e / sigma_i )
Bsp: eine Temperatur von 18oCelsius und Kalium K+ mit Valenz 1 und einer Konzentration aussen mit 20 mmol und innen mit 400 mmol ergibt:
- 77.63 [mV] = - 0.1985 * 273.15+18 * 1 * log10( 20 / 400 )
STARTEs soll nun beispielhaft analysiert werden, wie man das vorausgehende Beispiel in ein abstraktes Modell und dann später in ein realisiertes Modell überführt. Diese Analyse soll mit den Mitteln der Systemtheorie vorgenommen werden. Um zu verstehen, warum man hier die Systemtheorie anwenden kann, um einen Prozess zu analysieren, muss man sich vor Augen führen, dass sich das Prozessmodell, das in der ersten Vorlesung vorgestellt worden ist, sich ohne Probleme in ein Systemmodell umformen lässt (siehe Bild).
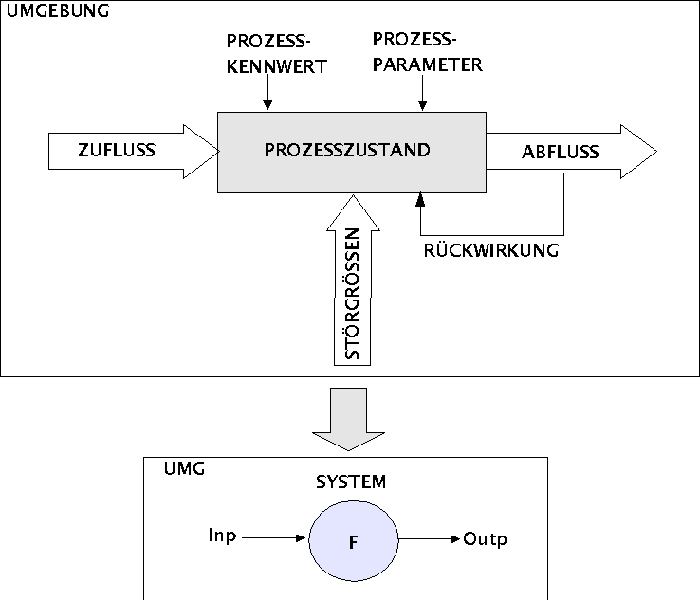
Vom Prozess zum System
Dazu genügt es, den Begriff Prozess durch den Begriff System zu ersetzen und sämtliche Eingänge des Prozesses nun zum System-Input zusammenzufassen und analog sämtliche Ausgänge eines Prozesses als Systemoutput.
Nach dieser Vereinbarung kann man dann für Systeme die übliche Schreibweise einführen (für die Notation in mengentheoretischer Sprache siehe hier.)
SYSTEM(s) <==> s = <O,R >
s ist ein SYSTEM genau dann, wenn s ein 2-Tupel ist mit der Menge O und der Relation R. Die Relation R charakterisiert dann die Beziehung zwischen den Elementen der Menge O.
In vielen Fällen kann die Basismenge selbst eine Stuktur besitzen, die dadurch entsteht, dass elementare
mengentheoretische Operationen wie Mengenprodukt ('M x M'), n-faches kartesisches Produkt ('Mn') sowie
Potenzmenge ('2M' oder 'pow(M)') auf verschiedene Basismengen und dann auf deren Ergebnisse mehrfach
angewendet werden. Z.B. kann aus einer einfachen Basismenge folgende komplexe Mengenstruktur erzeugt werden:
O = pow(M4) x pow(N2).
Ausserdem ist die Relation R in den meisten Fällen nicht nur einfach eine Relation, sondern eine Relation mit den zusätzlichen Eigenschaften der Vollständigkeit und Rechtseindeutigkeit, also eine Funktion, die Systemfunktion. In diesem Fall schreiben wir statt 'R' auch 'F':
SYSTEM(s) <==> s = <O,F >
Auch die Systemrelation bzw. Systemfunktion kann komplex aus mehreren einfachen Relationen bzw. Funktionen aufgebaut sein. So könnte die Funktion f z.B. aus einer Konkatenation von mehreren Funktionen fi gebildet werden --etwa: F = f0 o f1 o f2 -- und jede dieser Teilfunktionen fi könnte wiederum auf unterschiedliche Weise zusammengesetzt sein.
Betrachten wir dazu zwei einfache Beispiele, Ionenkanäle und Ionenpumpen.
ICH(c) <==> s = << {SE}, {SI}, {CAP}, REC>,Fch >
c soll ein Ionenkanal ICH ('ionic channel') sein, wenn er aus einem 2-Tupel besteht mit den Objekten "SE, SI, CAP, REC" sowie der Systemfunktion Fch. Die Bedeutung der einzelnen Elemente ist die folgende:
SE := externe Substanzkonzentration gemessen in MiliMol [mmol]
SI := interne Substanzkonzentration gemessen in MiliMol [mmol]
CAP := Kapazität ('capacity') des Kanals gemessen in Anzahl der Ionen pro Zeiteinheit
REC := Zustand des Rezeptors, der den Kanal steuert
Fch := Systemfunktion
Mit folgender Konkretisierung:
SE in Rel+ /* Rel+ als Bezeichnung für die rellen Zahlen */
SI in Rel+
CAP in Rel+
REC = {0,1} mit 0 := nicht aktiv und 1 := aktiv.
Fch: {SE} x {SI} x {CAP} x REC ---> {SI}
Auf der Basis der Werte von {SE} x {SI} x {CAP} x REC berechnet die Systemfunktion einen neuen Wert für SI.
Obwohl an dieser Stelle das System nur erst sehr abstrakt beschrieben worden ist, stellt diese Beschreibung dennoch schon eine Vorentscheidung dar bzgl. der Komponenten, die man im System wirksam sieht und bzgl. des Zusammenwirkens dieser Komponten im Rahmen der Systemfunktion F. Ist man mit diesen vorentscheidungen einverstanden, folgen aus diesen ersten groben Annahmen weitere Entscheidungen bzgl. der Details der angenommenen Komponenten.
Man könnte die Funktion --in einer ersten Annäherung-- etwa in der folgende Weise festlegen:
Wenn <e,i,c,r> in dm(Fch) & r=1, dann soll gelten:
Fch(e,i,c,r) =
i-c, wenn i > e & i-c > 0
0, wenn i > e & i-c < 0
i+c, wenn i < e
Damit wird das Verhalten des Kanals beschrieben:
Ist der Receptor in einem aktiven Zustand (r=1) und damit der
Kanal geöffnet,dann gibt es drei Fälle:
(i) die interne Konzentration ist grösser als die externe Konzentration (i > e) und die Kanalkapazität führt nicht zu
einer Verminderung unter 0 (i-c > 0), dann wird die innere Konzentration einfach um die Kapazität vermindert;
(ii) die interne Konzentration ist grösser als die externe Konzentration (i > e) aber die Kanalkapazität würde
zu einer Verminderung unter 0 führen (i-c < 0), dann wird die innere Konzentration bis auf 0 vermindert;
(iii) die interne Konzentration ist kleiner als die externe Konzentration (i < e), dann wird die innere Konzentration
um die Kanalkapazität erhöht.
Diese Modellierung eines Ionenkanals ist zwar noch sehr einfach, soll uns aber zunächst mal als Ausgangspunkt dienen, um das Prinzip zu verstehen.
STARTWird in der Übung vorgestellt.
STARTAnhand eines einfachen Beispiels wurde gezeigt, wie man dieses im Rahmen der Systemtheorie analysieren kann und wie sich diese Modelle in ablauffähige und anwendungsnahe Simulationsmodelle im Rahmen von scilab reformulieren lassen; diese Konzepte werden an einem weiteren Beispiel vertieft werden. Zusätzlich werden weitere wichtige Begriffe aus der Prozessrechnertechnik eingeführt werden.
Übungsaufgabe:
Übertragen sie das Analysebeispiel des Ionenkanals auf die Ionenpumpe: analysieren sie die Struktur einer Ionenpumpe; geben Sie eine System-Struktur an.
Testfragen:
Wie beschreiben sie den Problemkontext, innerhalb dessen der/die IngenieurIn seine/ihre Aufgabe wahrzunehmen hat?
Geben Sie eine umgangssprachliche Beschreibung des Aufbaus und der Funktionsweise einer Synapse, insbesondere jenes Teils, der als postsynaptische Membran bezeichnet wird.
Welcher besonderer Beitrag kommt den Kanälen und Pumpen zu? Wie ergänzen sich Kanäle und Pumpen?
Welchen Sachverhalt beschreibt die Nernst-Gleichung? Geben Sie ein konkretes Berechnungs-Beispiel.
Warum kann man einen Prozess auch als System darstellen?
Was ist die formale Struktur eines Systems?
Wie kann man das Systemobjekt intern weiter strukturieren?
Wie kann man die Systemfunktion weiter strukturieren?
Geben Sie 2-3 Beispiele von konkreten Systemen an mit Systemobjekt und Systemfunktion.
Wie können Sie ein konkretes System in eine scilab-Darstellung übersetzen?
Geben Sie 2-3 konkrete Beispiele von Systemen und ihren scilab-Darstellungen.